21世纪经济报道记者武瑛港 实习生魏柯 北京报道 近期国内多个创新肿瘤精准治疗药物新适应症获批。7月12日,第一三共与阿斯利康联合开发的ADC药物注射用德曲妥珠单抗(ENHERTU®)获批单药适用于治疗部分不可切除或转移性HER2低表达(IHC 1+或IHC 2+/ISH-)成人乳腺癌患者。
此外,近日基石药业宣布其选择性RET抑制剂普拉替尼胶囊扩展适应症已获批,用于RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗;恒瑞医药宣布其新型高选择性CDK4/6抑制剂羟乙磺酸达尔西利片新增适应症,可联合芳香化酶抑制剂作为初始治疗,适用于部分局部晚期或转移性乳腺癌患者。
据行业媒体梳理,2023年上半年,我国新获批药物(不包括中成药与疫苗)20款,覆盖肿瘤、抗感染、罕见病等多个领域,其中肿瘤类药物最多,包含多款抗肿瘤靶向精准治疗药物。但是根据国家癌症中心官微信息,在过去十年中,肿瘤靶向治疗在全球取得了巨大进展和成就,中国在抗肿瘤药物开发方面也获得了蓬勃发展,但国内关于抗肿瘤靶向药物总体研发进展的证据仍相对不足。
值得关注的是,近期国家癌症中心/中国医学科学院肿瘤医院副院长李宁教授团队在JNCC发文,以国家权威数据库为基础,全面揭示了2012年初至2021年底中国靶向抗肿瘤药物临床试验和审批的广阔格局及变化趋势,同时找出其中的关键障碍,为促进我国靶向抗癌药物的开发提供相应解决方案和数据依据参考。
国内企业或成支柱
上述文章显示,我国抗肿瘤靶向药物研发蓬勃发展,试验数量和比例、试验品种、上市药品逐年显著增加,一定程度上显示出个性化医疗在中国的实施对医药市场和医疗体系的可持续发展具有吸引力。
根据文章数据,2012–2021年十年间,共有1167种抗肿瘤靶向药物开展2632项临床试验,占所有注册抗肿瘤试验的81.5%;靶向药物试验的数量和比例呈稳步增长趋势,平均增长率分别为36.0%和6.2%。
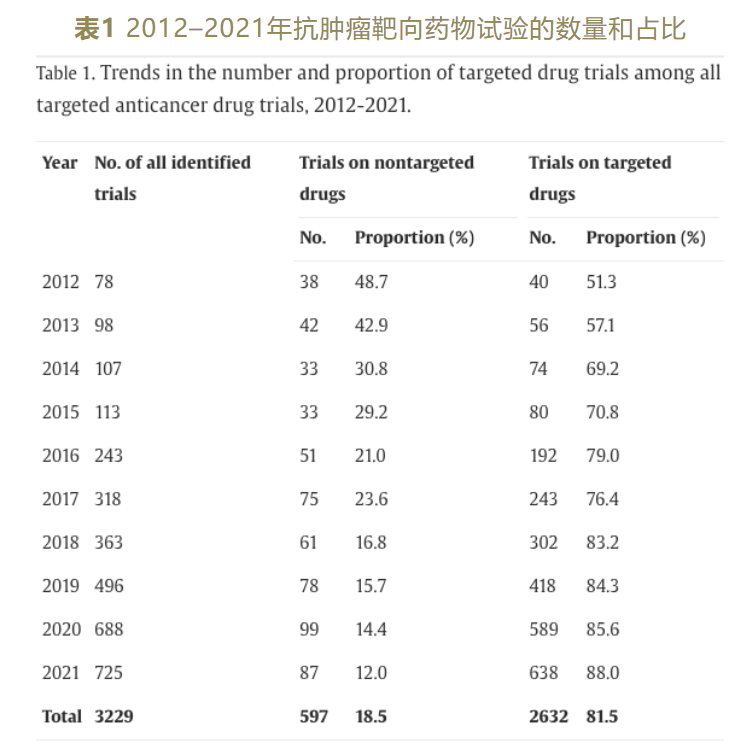
图片来源:国家癌症中心官微信息
据介绍,其中抗肿瘤临床试验和涉及药物的数据主要来源于中国食品药品监督管理总局(CFDA)临床试验登记数据库的注册信息公示平台,数据时间从2012年1月1日起至2021年12月31日止。
其实,近年来,包括靶向治疗在内的精准治疗越来越受到青睐。国家癌症中心曾发布信息分析称,随着科学技术的进步和不同学科专业知识及数据的结合,个性化医疗作为一个交叉领域逐步发展,让医务人员逐渐能够在癌症的控制和治疗中为每个患者选出最佳治疗方案。
传统循证医学根据癌症部位粗略地对肿瘤进行分类,并没有充分认识到个体基因突变的特异性与复杂性,而个性化医疗的发展和应用对于改善肿瘤患者的预后至关重要。
例如从FDA获批上市的肿瘤药物来看,根据平安证券研报数据,1997年FDA批准了第一个靶向肿瘤药物利妥昔单抗,开启了肿瘤治疗新时代;1997年至2005年间有少数靶向小分子和大分子单抗上市,靶向药物快速发展;2005至2017年间FDA批准的抗肿瘤药物中,靶向药物所占比例越来越高。2015年批准的14个抗肿瘤药物中,靶向药物达到12个,2016、2017年批准的全部都是靶向药物。
后续靶向和免疫治疗等精准疗法的药物种类和普及程度加速提升,据中航证券研究所分析,从抗肿瘤创新药研发上来看,靶向治疗和免疫治疗因针对未满足临床需求,成为中国创新药企业争相布局的制高点。
在整个肿瘤靶向治疗领域快速发展的同时,国内企业实力也在快速增强。
李宁教授团队发布的上述文章显示,通过研究国内外企业的对比发现,在抗肿瘤药物研发全面进入精准靶向治疗时代后,国内企业成为中国的支柱。
十年间,国内企业的靶向试验药物数量和靶向药物临床试验占比迅速增长,分别达到33.7%和13.8%的年增长率。相对来说,国外企业发起靶向药物试验的总占比高于国内企业(85.6%vs.80.5%),但国内企业与国外企业在药物品种占比(2021年为84.4%vs.87.0%)和试验占比(2021年为87.4%vs.88.0%)的差距逐步缩小。目前共有126种免疫药物、18个靶点正在开发,其中仅有一个为尚未获批上市的全新靶点。
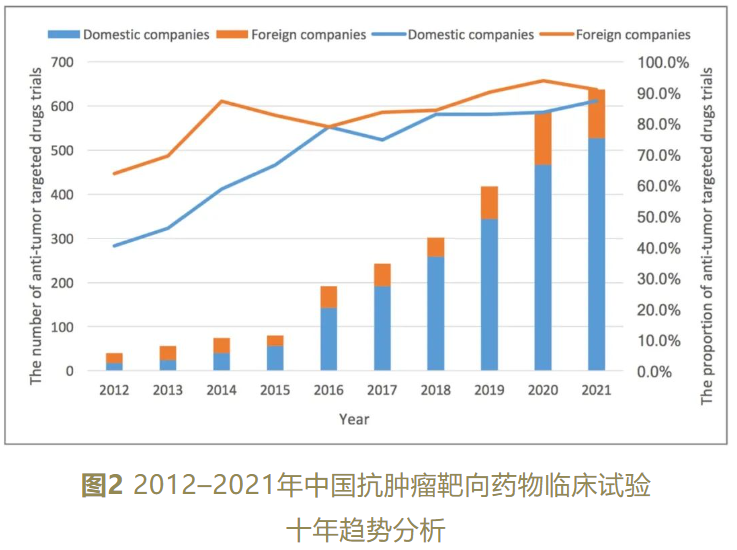
图片来源:国家癌症中心官微信息
对此,李宁教授团队在上述文章中分析称,我国抗肿瘤靶向药物取得巨大进展可能主要归功于三个方面,进而得以形成良性循环。
首先,全球抗癌药物研发的学术和工业进步推动了中国及其他地区的发展;其次,中国药品创新生态系统逐步完善,这与2015年以来一系列改革带来的加速有很大关联,吸引了更多的国内外企业投资,带动了企业的可持续发展;另外,个性化医疗在改善医疗保健方面的巨大潜力引发了政策制定者对包括中国在内的全球更高效和可持续的医疗保健系统的关注和投入。
因此,以国内企业高质量发展为抓手,推动中国医药研发向前发展,是未来十年靶向抗肿瘤药物开发的关键,尤其是其创新型药物开发的关键。
研发模式必须转变
在快速发展的同时,李宁教授团队在文章中也指出,基于快速随访模式,中国靶向抗癌药物取得了显著发展,但上市的药物并非同类首创。
中国几乎所有正在开发的靶点都已经有产品投放市场,国内企业的全球化程度明显低于外国企业。这意味着中国企业短期内仍无法向世界贡献一流的靶向抗肿瘤新药。在中国融入研发全球化的新时代,中国的研发模式必须从“me-better”向“first-in-class”转变,从创新能力、创新内外力、创新生态等角度出发。
国家新药咨询委员朱迅曾就此问题告诉21世纪经济报道,真正的原始创新药,第一必须是全球首创,第二要得到国际认可,第三应该在国际市场上拥有足够的市场份额及一定销售额,以上三点缺一不可。
但是目前不只是me-too类药品进入白热化竞争,first-in-class和me-better产品都面临着很大的挑战。
据朱迅分析,对于first-in-class,其失败率非常高,从临床到审批上市,全球成功率不超过8%;对于me-better药物,虽然first-in-class不一定是best-in-class,但是因为研发新药投入的成本大幅增高,产品上市后被超越的代价太大,所以企业在前期都会不断进行优化,大部分新药上市已经85分,后续其他企业再做me-better难度会非常大。60分的药品和80分的药品区别很大,但是85分和90分没太大区别。
除了药物首创问题,李宁教授团队还在文章中强调,中国的人类遗传资源在精准医学研究的可持续发展中发挥着不可或缺的作用。它们在肿瘤学研究和多中心研究中尤为突出,中国不断加强立法和伦理,初步建立了从生物资源采集到出口的较为完善的法律体系和伦理准则。
研发机构普遍认为,与美国相比,中国对人类遗传资源的控制相对严格。美国通过制定标准的生物材料转让协议,规范和管理科学研究项目中人类遗传资源材料的转让。中国人类遗传资源的对外转移也由政府管理,但是样品出口要求较为严格,过程也较为耗时。
中国人类遗传资源的向外转移也需要得到政府的批准,样品出口应经过严格的申请流程,包括伦理审批、研究审批、行政授权等。只有合法的国内实体才能出口资源,因此应加强国家层面的整体布局,促进靶向药物和个性化药物的发展。
对此问题,李宁教授团队在文章中指出,一方面,鉴于临床基因组学在癌症中的根本重要性,研发组织应倡导鼓励基因组学活动的法规和政策以及相关国际活动。另一方面,还应共同建立国家资源战略保护平台,规范样本数据的安全存储和共享,确保患者隐私和数据安全得到保护。此外,还应建立激励措施和公私合作框架,以促进学术界和行业利益相关者获取用于研究目的的生物样本和数据,这对于中国创新靶向抗肿瘤药物的可持续研发也至关重要。
据了解,早在1986年,诺贝尔奖得主Delbecco就提出:欲解决肿瘤问题,就要先搞清楚基因组。
中国科学院院士杨焕明也曾表示,肿瘤的基因组学现在主要聚焦在基因的突变、易位以及染色体结构改变等,对于阐明肿瘤的分子机制,实现肿瘤的预防、早诊断、精准治疗具有重大意义,可以说肿瘤基因组的出现,是肿瘤领域研究的重大转折点。
例如肿瘤的预防,通过检测肿瘤基因组的改变,可以预测家族中具有遗传倾向的肿瘤的患病风险,达到预防肿瘤的目的;肿瘤的早诊断,通过对体液或者分泌物中游离DNA的测序,获得肿瘤的基因组信息,达到肿瘤早期筛查的目的;肿瘤的精准治疗,对于已经诊断为肿瘤的患者,通过检测肿瘤细胞和肿瘤微环境基因组的变化,获知分子信号通路的变化,为患者制定个性化的治疗方案。